
Depuis plus de 23 ans, les médicaments biologiques constituent une option thérapeutique pour les patients atteints d’arthrite inflammatoire. Aujourd’hui, il existe des versions biologiques biosimilaires (« biosimilaires ») des biologiques d’origine (« médicaments d’origine ») qui ont perdu la protection de leur brevet. Pour recevoir l’approbation de Santé Canada, un biosimilaire doit démontrer qu’il est très similaire et qu’il ne présente aucune différence cliniquement significative en matière d’innocuité et d’efficacité par rapport au médicament d’origine.[1]
Un biosimilaire est généralement prescrit aux patients par un rhumatologue. Par exemple :
- l’adalimumab (Abrilada®), l’adalimumab (Amgevita®), l’adalimumab (Hadlima®), l’adalimumab (Hulio®), l’adalimumab (Hyrimoz®), l’adalimumab (Idacio®), l’adalimumab (Simlandi®) et l’adalimumab (Yuflyma®) sont des versions biosimilaires du biologique d’origine adalimumab (Humira®)
- l’étanercept (Brenzys®), l’étanercept (Erelzi®) et l’étanercept (Rymti®) sont des versions biosimilaires du biologique d’origine étanercept (Enbrel®)
- l’infliximab (Avsola®), l’infliximab (Inflectra®), l’infliximab (Remsima®SC) et l’infliximab (Renflexis®) sont des versions biosimilaires du biologique d’origine infliximab (Remicade®)
- le rituximab (Riabni®), le rituximab (Riximyo®), le rituximab (Ruxience®) et le rituximab (Truxima®) sont des versions biosimilaires du biologique d’origine rituximab (Rituxan®)
Approuvés pour utilisation au Canada depuis 2009, les biosimilaires sont approuvés pour le traitement de l’arthrite inflammatoire depuis 2014. À l’heure actuelle, 52 biosimilaires ont reçu l’autorisation de Santé Canada. L’Union européenne (UE) a approuvé le premier biosimilaire en 2006 et compte actuellement 88 biosimilaires approuvés. Aujourd’hui, l’expérience clinique totale avec les médicaments biosimilaires dépasse les 2 milliards de jours de traitement avec des biosimilaires approuvés par l’UE.[2]
Sur la base de ces preuves scientifiques et des données du monde réel, les rhumatologues de partout au Canada prescrivent maintenant régulièrement des biosimilaires à leurs patients atteints d’arthrite inflammatoire qui ont récemment débuté la prise d’adalimumab, d’infliximab, d’étanercept et de rituximab, et en consultation pleine et entière avec leurs patients, commencent à faire la transition du médicament d’origine à son biosimilaire.
Les biosimilaires ne sont pas des génériques des médicaments d’origine.
Les biosimilaires sont similaires, mais pas identiques, à leurs médicaments d’origine.
Pourquoi les biologiques biosimilaires ont-ils été mis au point et approuvés ?
Pourquoi les biologiques biosimilaires ont-ils été mis au point et approuvés ?
Les biologiques sont des médicaments pouvant aider les patients atteints de maladies graves telles que l’arthrite inflammatoire, le cancer, le diabète, la maladie inflammatoire de l’intestin, la sclérose en plaques et le psoriasis. Cependant, il s’agit de médicaments complexes et très coûteux dont le développement peut prendre un temps considérable. Pour les patients, cela signifie un accès restreint à ces médicaments et une couverture coûteuse pour le système de soins de santé. Qu’est-ce que cela signifie pour les régimes d’assurance-médicaments provinciaux ? Selon les données de l’Institut canadien d’information sur la santé, les dépenses des régimes d’assurance-médicaments publics pour les médicaments biologiques ont atteint 4,4 millards de dollars en 2021 (29 % des dépenses totales des régimes d'assurance-médicaments publics). Pour la dixième consécutive, les médicaments biologiques anti-TNF utilisés pour la polyarthrite rhumatoïde et la maladie de Crohn ont représenté la plus grande proportion des dépenses totales du régime d'assurance-médicaments public.[3]
Les biosimilaires ont la possibilité d’améliorer l’accès aux biologiques pour les patients et de permettre aux systèmes de soins de santé, autant publics que privés, d’économiser des milliards de dollars maintenant et au cours des années à venir. Une étude commandée par le Conseil d’examen du prix des médicaments brevetés (CEPMB) du gouvernement canadien a estimé que les régimes d’assurance-médicaments privés et publics du Canada pourraient économiser entre 332 millions et 1,81 milliard de dollars canadiens au cours de la 3e année suivant l’introduction d’un biosimilaire dans un portefeuille de produits.[4]
Pourquoi les biologiques biosimilaires sont-ils moins coûteux que les biologiques d’origine ?
Pourquoi les biologiques biosimilaires sont-ils moins coûteux que les biologiques d’origine ?
Un fabricant de médicaments biologiques doit consacrer de nombreuses années à l’étude d’un nouveau médicament biologique avant qu’il puisse être approuvé au Canada. L’entreprise détient ensuite un brevet sur le médicament qui empêche les autres entreprises de vendre ce médicament. Cela permet au fabricant du médicament d’origine de récupérer l’argent qu’il a dépensé pour mettre le médicament sur le marché. Lorsque le brevet d’un médicament d’origine expire, d’autres fabricants sont autorisés à fabriquer une version biosimilaire du médicament. Les fabricants qui produisent des biosimilaires d’autres médicaments biologiques d’origine n’ont pas les mêmes coûts pour mettre le médicament sur le marché et peuvent donc le proposer à un prix inférieur.[5]
Quels sont les avantages des biologiques biosimilaires pour les patients et notre système de soins de santé ?
Quels sont les avantages des biologiques biosimilaires pour les patients et notre système de soins de santé ?
Les biosimilaires représentent trois principaux avantages pour les patients, le système de soins de santé et la société en général :
- Les économies réalisées grâce à l’utilisation de biosimilaires peuvent stimuler un réaménagement des « critères d’accès spécial » qui obligent actuellement les patients à faire l’essai d’anciens médicaments moins coûteux sans obtenir de résultats satisfaisants. Puisque les biosimilaires sont beaucoup moins onéreux, les listes de médicaments remboursables, autant privées que publiques, pourraient facilement laisser tomber cette obligation d’essai non concluant avant d’approuver le remboursement des biosimilaires pour ces patients;
- Les économies réalisées grâce à l’utilisation des biosimilaires peuvent être réinvesties dans les budgets consacrés aux listes de médicaments remboursables par les régimes privés et publics, permettant ainsi d’améliorer la viabilité de leurs régimes d’assurance-médicaments en ajoutant de nouvelles listes de médicaments et en renforçant la couverture des médicaments existants pour les patients; et,
- Les économies générées par les biosimilaires pourraient être investies dans des aspects non médicaux dont ont besoin les patients, tels que les soins infirmiers spécialisés, les services de conseils professionnels de même que la physiothérapie et l’ergothérapie.
Références
[1] Santé Canada – Fiche d’information sur les biosimilaires
[2] Medicines for Europe: Biosimilar use in Europe (Décembre 2020) (en anglais seulement)
https://www.medicinesforeurope.com/wp-content/uploads/2020/12/BIOS5.pdf
[3] Institut canadien d’information sur la santé – Dépenses publiques en médicaments prescrits au Canada en 2020 (infographie)
https://www.cihi.ca/fr/depenses-publiques-en-medicaments-prescrits-au-canada-en-2020
[4] Conseil d’examen du prix des médicaments brevetés, Gouvernement du Canada. Affiche : Économies potentielles associées aux biosimilaires au Canada.
http://www.pmprb-cepmb.gc.ca/CMFiles/NPDUIS/2017_Conference_Posters/post_6_biosim.pdf
[5] Agence canadienne des médicaments et des technologies de la santé – Les médicaments biosimilaires : Réponses à vos questions
https://www.cadth.ca/sites/default/files/pdf/biosimilar_drugs_patient_tool_fr.pdf
FAQ sur les biologiques biosimilaires
Qu’est-ce qu’un biologique ?
Aujourd’hui en Amérique du Nord, en Europe et en Asie, plus de biologiques, d’origine et biosimilaires, sont utilisés pour le traitement de l’arthrite inflammatoire que pour n’importe quelle autre maladie.
Au cours des 23 dernières années, les biologiques sont devenus une option thérapeutique vitale pour les patients atteints de maladies chroniques graves, y compris les patients souffrant d’arthrite inflammatoire, dont la maladie ne répond pas aux antirhumatismaux modificateurs de la maladie synthétiques conventionnels (ARMM-sc) comme l’hydroxychloroquine ou la sulfasalazine.
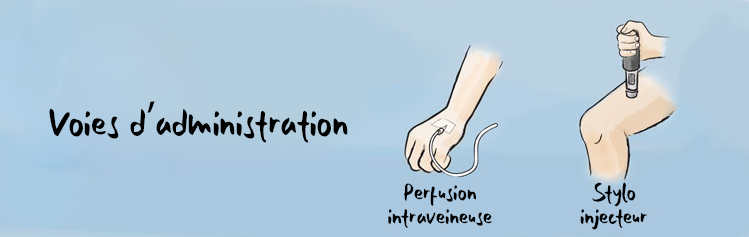
Les médicaments biologiques sont fabriqués à partir d’organismes vivants comme les levures et les bactéries. La première version d’un biologique développée est connue sous le nom de « biologique d’origine ». Cela s’explique par le fait qu’il s’agit de la version originale d’un médicament à partir duquel un biosimilaire est fabriqué. Les médicaments biologiques sont plus volumineux et de composition plus complexe que les médicaments conventionnels à petite molécule offerts en vente libre, comme l’ibuprofène (Advil), ou sur ordonnance, comme la méthotrexate (voir figure 1). Les médicaments biologiques sont administrés de deux façons : par auto-injection sous-cutanée ou intramusculaire, ou par perfusion intraveineuse (IV) dans une veine de la main, du poignet ou du bras.
Qu’est-ce qu’un biologique biosimilaire ?
Lorsque les brevets des médicaments d’origine expirent, d’autres fabricants peuvent produire de nouvelles versions similaires dont l’innocuité et l’efficacité sont démontrées. Ces nouvelles versions sont appelées biosimilaires.[1] Comme les médicaments d’origine sont volumineux et complexes, les biosimilaires peuvent être très similaires, sans être identiques.
L’utilisation des biosimilaires est approuvée au Canada depuis 2009 et pour l’arthrite inflammatoire, depuis 2014. Cinquante-deux biosimilaires sont actuellement approuvés par Santé Canada.
[1] Santé Canada – Médicaments biologiques biosimilaires au Canada : fiche d’information
Les biologiques biosimilaires sont-ils des biologiques génériques ?
Les médicaments génériques sont des copies de médicaments de marque. Comportant le même ingrédient actif, ils sont identiques au médicament de marque en matière de forme posologique, d’innocuité, de force, de voie d’administration, de qualité, de performance et d’utilisation prévue.
Les biosimilaires, tout comme les médicaments génériques, sont des versions moins coûteuses de médicaments de marque (médicaments d’origine). Les médicaments biologiques d’origine ont déjà jeté les bases de la recherche et du développement des biosimilaires, ce qui signifie que les biosimilaires sont plus rentables à produire et donnent des résultats similaires. Cependant, les biosimilaires ne sont pas identiques aux médicaments génériques car, contrairement aux médicaments non biologiques, les biologiques sont souvent plus volumineux et plus complexes et ne peuvent être copiés à l’identique.
Il existe de très petites différences entre les différents lots d’un biologique d’origine. Cela s’explique par le fait qu’ils sont fabriqués à partir d’organismes vivants présentant de minuscules différences naturelles. Il en va de même pour les légères différences entre un biosimilaire et son biologique d’origine, qui ne sont pas non plus cliniquement significatives.
Qu’est-ce que l’immunogénicité ?
Le système immunitaire a évolué de façon à pouvoir reconnaître des protéines étrangères dans l’organisme. Les biologiques sont habituellement injectés dans le corps et le système immunitaire réagit souvent à cette intrusion. On parle alors de l’immunogénicité d’un produit. Parfois, l’immunogénicité ne peut être détectée qu’au moyen d’analyses de laboratoire sophistiquées et n’a aucun impact sur le patient alors que dans d’autres cas, l’immunogénicité peut avoir un impact sur l’innocuité et sur l’efficacité du médicament. Pour ces raisons, des études démontrant qu’il n’y a pas de différences cliniquement significatives en matière d’immunogénicité entre le médicament d’origine et le biosimilaire sont requises pour l’approbation d’un biosimilaire. En outre, les fabricants de biosimilaires sont tenus de surveiller le potentiel d’immunogénicité du biosimilaire après son utilisation au Canada.[1]
[1] Santé Canada – Médicaments biologiques biosimilaires au Canada : fiche d’information – L’immunogénicité et la façon dont nous l’abordons pour les médicaments biosimilaires
Qu’est-ce que l’interchangeabilité ?
Au Canada, l’interchangeabilité réfère souvent à la capacité du pharmacien de remplacer un médicament par un médicament équivalent au moment de la délivrance au patient sans l’intervention du médecin prescripteur, lorsque ce médicament est considéré interchangeable par l’organisme de réglementation provincial ou territorial. Il s’agit d’une pratique courante de substituer à un médicament dont le brevet est expiré un produit générique équivalent, considéré comme interchangeable.
Actuellement et en ce qui a trait aux biosimilaires, Santé Canada a déclaré que les biosimilaires n’étaient pas considérés comme étant interchangeables avec leur médicament d’origine. L’approbation d’utilisation d’un biosimilaire par Santé Canada est accordée indépendamment des décisions de la province, du territoire ou des systèmes d’assurance-médicaments privés concernant leur ajout aux listes de médicaments remboursables ou à l’interchangeabilité entre ces produits. En vertu des nouvelles lignes directrices de Santé Canada, les décisions concernant l’interchangeabilité sont du ressort des gouvernements provinciaux et territoriaux. Ces derniers régissent également les pratiques de substitution en pharmacie.
Que signifie « transition » ou « changement » ?
Les termes « changement » ou « transition » signifient qu’un patient passera d’un médicament à un autre. Dans le cas des biosimilaires, il existe deux types de transitions :
La « transition médicale » survient lorsqu’un patient ne répondant pas adéquatement au traitement actuel avec un médicament d’origine ou biosimilaire fera la transition vers un autre biologique d’origine ou un autre biosimilaire, sur la base d’une décision prise par le patient et son rhumatologue, dans le but de reprendre un maximum de contrôle sur l’évolution de la maladie.
La « transition par politique » (ou changement non médical) survient lorsqu’un régime d’assurance-médicaments public ou privé exige que les patients passent de leur médicament d’origine actuel à son biologique biosimilaire.
Les patients doivent-ils passer aux biologiques biosimilaires au Canada ?
Au cours des sept dernières années, les régimes d’assurance-médicaments provinciaux du Canada ont inscrit les marques biosimilaires avant les médicaments d’origine pour les patients naïfs de traitement (patients qui n’ont pas déjà reçu le médicament d’origine). Depuis 2019, les régimes d’assurance-médicaments provinciaux et territoriaux, dont ceux de l’Ontario, de la Colombie-Britannique, du Québec, de l’Alberta, du Nouveau-Brunswick, de la Nouvelle-Écosse, des Territoires du Nord-Ouest, de la Saskatchewan, de Terre-Neuve-et-Labrador et du Yukon, ont également commencé à mettre en œuvre des politiques permettant aux patients de passer d’un médicament d’origine à un biosimilaire tout aussi sûr et efficace et approuvé par Santé Canada.[1] Dans le cadre d’une politique de transition, les patients disposent d’une certaine période pour discuter avec leur médecin prescripteur de la transition d’un médicament d’origine vers un biosimilaire et obtenir une ordonnance pour le biosimilaire afin de conserver la couverture de leur régime d’assurance-médicaments. Les patients qui ne sont pas en mesure d’effectuer la transition vers le biosimilaire pour des raisons médicales peuvent faire des demandes exceptionnelles de maintien de la couverture du médicament d’origine.[2]
Avant de procéder à la transition, les médecins et leurs patients doivent être pleinement informés et disposer de toutes les informations disponibles sur le médicament biosimilaire, telles que les détails sur la politique de remboursement, les informations sur le programme de soutien aux patients, y compris les noms et numéros de téléphone des personnes à contacter.
[1] Colombie-Britannique - L’initiative sur les biosimilaires pour les patients (en anglais seulement)
Alberta - Croix Bleue - L’initiative sur les biosimilaires financée par le gouvernement (en anglais seulement)
https://www.ab.bluecross.ca/government-plan/biosimilar-initiative.php
Nouveau-Brunswick - L’initiative sur les biosimilaires pour les patients
Gouvernement du Québec - Régime d’assurance médicaments – Couverture des médicaments biosimilaires
https://www.ramq.gouv.qc.ca/fr/citoyens/assurance-medicaments/connaitre-conditions-couverture-regime
[2] Colombie-Britannique - L’initiative sur les biosimilaires pour les patients (en anglais seulement)
Position de Santé Canada sur la transition
Dans le contexte de l’utilisation d’un médicament biosimilaire, Santé Canada « considère que le changement entre produits autorisés renvoie au passage de l’utilisation courante d’un produit spécifique à l’utilisation courante d’un autre produit spécifique. Les patients et les fournisseurs de soins de santé peuvent avoir confiance en le fait que les médicaments biosimilaires sont efficaces et sécuritaires pour chacune de leurs indications autorisées. Aucune différence d’efficacité et d’innocuité n’est prévue à la suite d’un changement d’utilisation courante entre un médicament biosimilaire et son médicament biologique de référence pour une indication autorisée. [1]
Qu’est-ce que l’effet nocebo ?
La transition d’un patient d’un médicament d’origine vers un biologique biosimilaire peut parfois être associée à un possible effet « nocebo », un phénomène qui se produit lorsque les convictions négatives d’un patient envers un médicament entraînent des effets indésirables plus marqués que généralement observés pour ce médicament. Essentiellement, il s’agit ici de l’effet inverse de l’effet placebo.
La façon qu’auront les rhumatologues et les autres fournisseurs de soins de santé de communiquer avec les patients à propos de la transition vers un biosimilaire est au cœur même de la prévention de l’effet nocebo. Les patients devraient être informés bien à l’avance de la transition. L’accès à de l’information pertinente fondée sur la recherche contribuera à la compréhension et à la responsabilisation du patient. Enfin, le temps alloué à une consultation avec un rhumatologue pour discuter de la transition vers un biosimilaire devrait être suffisamment long pour permettre au patient de bien comprendre le concept des biosimilaires et de la transition et d’aborder toutes les préoccupations de façon efficace.
Qu’est-ce que l’extrapolation ?
Dans le cas des biosimilaires, compte tenu de la façon dont ils ont été mis au point, il n’est pas toujours nécessaire de réaliser des études cliniques pour toutes les indications pour lesquelles l’efficacité du produit d’origine a été démontrée. Plutôt, il est possible d’étendre à d’autres indications les données d’une indication portant sur l’efficacité et l’innocuité. On parle alors d’extrapolation ou d’extension des indications. Une indication est un terme qui désigne l’utilisation d’un médicament pour traiter une maladie spécifique. De nombreux médicaments biologiques sont approuvés pour plus d’une indication.
Puisque le biosimilaire présente une structure et une fonction similaires à celles du biologique d’origine dont l’efficacité et l’innocuité ont été démontrées, il n’est donc pas nécessaire de refaire les études cliniques pour chacune des indications.
Médecins et patients peuvent donc avoir confiance dans l’utilisation d’un biosimilaire pour chacune des indications approuvées par Santé Canada.
Partagez les faits sur les biosimilaires
Grâce à une compréhension des biosimilaires fondée sur des données probantes, les patients peuvent avoir une conversation thérapeutique complète avec leur rhumatologue (ou autre spécialiste) afin de décider au mieux du choix de leur médicament, qu’il s’agisse d’un médicament biologique d’origine ou d’un médicament biologique biosimilaire.
Partagez cette page d’informations sur les biosimilaires avec un autre patient, votre professionnel de la santé, votre famille ou toute autre personne avec qui vous avez une conversation sur les biosimilaires.

Arthritis Consumer Experts
© 2000-2023 ACE Planning and Consulting Inc.

Le comité ACE remercie Arthrite-recherche (ARC) pour son examen scientifique des informations et des programmes du comité ACE et de JointHealthTM
Partagez les faits sur les biosimilaires
Grâce à une compréhension des biosimilaires fondée sur des données probantes, les patients peuvent avoir une conversation thérapeutique complète avec leur rhumatologue (ou autre spécialiste) afin de décider au mieux du choix de leur médicament, qu’il s’agisse d’un médicament biologique d’origine ou d’un médicament biologique biosimilaire.
Partagez cette page d’informations sur les biosimilaires avec un autre patient, votre professionnel de la santé, votre famille ou toute autre personne avec qui vous avez une conversation sur les biosimilaires.
Partagez les faits sur les biosimilaires
Grâce à une compréhension des biosimilaires fondée sur des données probantes, les patients peuvent avoir une conversation thérapeutique complète avec leur rhumatologue (ou autre spécialiste) afin de décider au mieux du choix de leur médicament, qu’il s’agisse d’un médicament biologique d’origine ou d’un médicament biologique biosimilaire.
Partagez cette page d’informations sur les biosimilaires avec un autre patient, votre professionnel de la santé, votre famille ou toute autre personne avec qui vous avez une conversation sur les biosimilaires.

Arthritis Consumer Experts
© 2000-2021 ACE Planning and Consulting Inc.

Le comité ACE remercie Arthrite-recherche (ARC) pour son examen scientifique des informations et des programmes du comité ACE et de JointHealthTM


Arthritis Consumer Experts
© 2000-2021 ACE Planning and Consulting Inc.

Le comité ACE remercie Arthrite-recherche (ARC) pour son examen scientifique des informations et des programmes du comité ACE et de JointHealthTM














